Riabilitazione Crociato Anteriore: una guida per il fisioterapista
Una guida completa per il fisioterapista sulla riabilitazione dopo ricostruzione del legamento crociato anteriore.
La lesione al legamento crociato anteriore è un infortunio disabilitante molto comune soprattutto tra la popolazione sportiva giovanile. Nonostante le odierne tecniche chirurgiche e gli attuali programmi di riabilitazione del crociato anteriore, i tassi di re-injury sono molto elevati: recenti dati suggeriscono che solo il 54-63% dei soggetti ritornano a livelli di partecipazione sportiva pre-infortunio (1).
Anatomia del legamento crociato anteriore
Il legamento crociato anteriore è una struttura connettivale con un decorso obliquo dall’alto verso il basso ed una lunghezza variabile tra 1.8 cm e 3.30cm. Il terzo centrale presenta un’ampiezza di spessore ridotto rispetto le estremità rendendolo più vulnerabile a strain meccanici (2).
È formato da 2 fasci, uno antero-mediale e uno postero-laterale che presentano un pattern lunghezza-strain differente in base alla posizione del ginocchio (2).
Le 2 principali funzioni del legamento sono meccaniche, limita la traslazione anteriore della tibia e la rotazione interna e neurosensoriali, invia tonicamante informazioni propriocettive alla corteccia somato-sensoriale. Una lesione dello stesso comprometterebbe entrambe le funzioni creando alterazioni biomeccaniche periferiche e una dead zone informativa corticale inducendo meccanismi di neuroplasticità maladattiva centrale (3).
In seguito ad intervento di ricostruzione i meccanoreccettori si ripopolano a distanza di circa 18 mesi ripristinando completamente o quasi il link neuro-sensoriale (4).
Tecniche di ricostruzione LCA
Il trattamento gold standard dopo una lesione al legamento crociato anteriore soprattutto all’interno della popolazione sportiva che necessita di una ripresa di attività ad alta domanda prestazionale risulta essere la chirurgia anche se, recenti dati in letteratura dimostrano una possibile gestione conservativa in quei pazienti che presentano un profilo cooper dopo 6-8 settimane post lesione (5).
Le principali tecniche chirurgiche sono suddivise in base al sito di prelievo e al tipo di innesto utilizzato in:
- Autograft
- Allograft
La più comune e la più utilizzata nei soggetti giovani e sportivi è la modalità Autograft che utilizza l’innesto tendineo del soggetto stesso, viceversa la modalità Allograft utilizza un innesto tendineo da donatore (6) (7).
L’autograft presenta numerosi vantaggi rispetto all’allograft (8):
- Maggior stabilità articolare;
- Minor tasso di re-injury (15 volte inferiore);
- Velocità di attecchimento più rapida.
A breve termine invece, l’Allograft presenta minor dolore post-chirurgico e minor rischio di dolore femoro-rotuleo e tendinopatia nel caso in cui si utilizzasse un innesto da tendine rotuleo (8).
Tra gli Autograft più utilizzati ricordiamo:
- Patellar tendon autograft (BPTB);
- Hamstring tendon autograft (HT);
- Quadriceps tendon autograft (QT).
A circa 15 anni di follow up, non ci sono significative differenze in termini di lassità anteriore, funzionalità e IKDC scores tra queste 3 modalità.
BPTB graft è quello statisticamente più stabile, ma con possibile rischio di lag sign e dolore femoro-rotuleo. Preferibile nei soggetti di sesso femminile che presentano dominanza quadricipitale e ridotta forza del complesso hamstring post trauma distorsivo.
HT graft presenta buone qualità meccaniche in vitro ma più lento attecchimento osseo (9), (10).
Infine, QT graft presenta buone qualità meccaniche comparabili al BTPB ma ridotto dolore post operatorio rispetto a BPTB e HT (9) (10).
HT è considerato il graft che presenta maggior forza meccanica ai test in vitro (fig 1) (10).
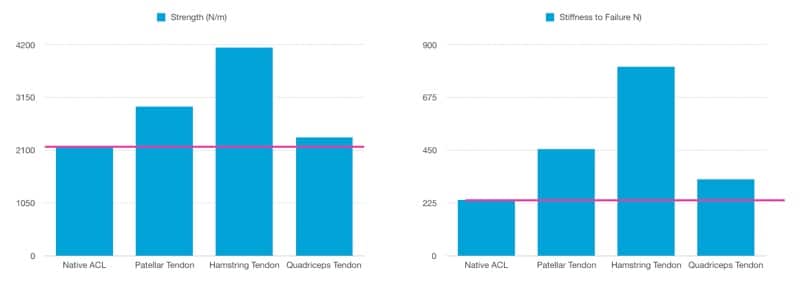
Le proprietà meccaniche del graft sono influenzate dalla fase di rimodellamento che ha una durata potenziale di circa 120 mesi (Zaffagnini et. al.) (12).
È presente un’enorme variabilità di dati in letteratura; la fase di rimodellamento del BPTB graft è più rapida del HT graft (6-7 mesi vs 12 mesi) (12).
I cambiamenti biologici a cui il neo-legamento viene sottoposto sono innumerevoli.
Studi recenti dimostrano che la forza del graft è migliore nella prima fase del processo di guarigione rispetto che a 3 mesi dove l’innesto apparirebbe più vulnerabile meccanicamente e metabolicamente a causa di alterazioni sistema-immunitario indotte (fig. 2).
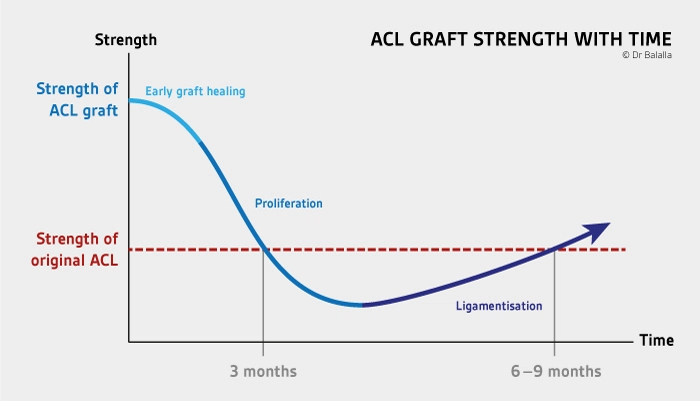
Questi dati giustificano l’importanza del rispetto dei tempi di recupero per il ritorno allo sport.
Tempi di recupero legamento crociato anteriore
Classicamente l’atleta era o è abituato a ritornare all’attività sportiva ad alto impatto a circa 6 mesi contrariamente a quello che la letteratura scientifica mette in luce ad oggi. I tempi di recupero in seguito a ricostruzione del legamento crociato anteriore sono invece più lunghi, alla luce delle attuali prove presenti in letteratura.
Sono infatti necessari 9-12 mesi per ridurre il rischio di re-injury come concordato dagli studi di Grindem et. al., 2016 (13).
Ma il tempo è un parametro sufficiente per la decision making del return to play?
Certamente no, ma necessario.
Siamo ancora lontani da un accordo su quali possano essere i criteri RTS più appropriati per un accurato decision making. Ma sappiamo ad oggi che:
- L’85% degli studi presenti in letteratura utilizzano come unico criterio singolare il tempo (14);
- L’analisi di forza viene utilizzata solo nel 41% degli studi (14);
- I performance test solo nel 14% (14).
Per esempio, relativamente all’analisi della forza ci sono ancora molti limiti. Il gold standard è l’isocinetica? Troppo poco.
Un’analisi qualitativa dovrebbe indagare l’intero spettro di forza comprendendo ogni parametro della curva forza-velocità.
Focalizzare quindi la riabilitazione con il solo scopo di ripristinare la forza, perdendo di vista quello che probabilmente serve ad un giocatore, è troppo riduttivo.
La forza è una determinante fondamentale ma è necessario trasferirla in un contesto prestazionale: potenza e forza reattiva, le 2 caratteristiche necessaria alla performance sportiva.
Gli atleti praticano gesti sportivi con tempi di reazione compresi tra i 90 e 150 ms richiedendo al sistema neuro-motorio grande brillantezza e capacità di reazione allo stimolo tenendo conto che solitamente una lesione legamentosa si aggira in un intervallo di tempo di 50-60 ms.
Detto ciò, abbiamo gli strumenti ed i mezzi per espandere la nostra pianificazione e programmazione riabilitativa nonché valutativa finale per poter almeno cercare di minimizzare il rischio di infortunio che sappiamo tutti essere un enorme black box.
Riabilitazione crociato anteriore: protocollo riabilitativo LCA
Nonostante sia uno degli argomenti più discussi in letteratura non ci sono ancora ad oggi delle linea guida di trattamento e gestione best practice. Non esiste nessun protocollo riabilitativo validato per la riabilitazione del legamento crociato anteriore.
Non esiste un approccio riabilitativo LCA gold standard ma, una riabilitazione basata su criteri, attraverso la programmazioni di fasi e di raggiungimento di obiettivi intermedi, è considerata essere la migliore strategie di gestione [24]. Il processo di recupero funzionale può essere ampiamente suddiviso in 5 fasi tempo e obiettivo dipendente: fase pre-operatoria, precoce-iniziale, intermedia e avanzata-finale (RTP) (Fig 3) (15).

La riabilitazione pre-operatoria mira a preparare il soggetto all’intervento, normalizzando il pattern del cammino, la funzionalità del ginocchio, minimizzando il versamento articolare e migliorando il reclutamento qualitativo del quadricipite. La letteratura scientifica mette in luce che la pre-riabilitazione ovvero un programma pre-chirurgico di 5–6 settimane si traduce in esiti post chirurgici a breve e lungo temine sensibilmente migliori rispetto a coloro che non la attuano [16-17]. La fase iniziale è focalizzata sul controllo e riduzione del dolore e del gonfiore, sul recupero di una sufficiente mobilità articolare tale da permettere l’esecuzione di attività di vita quotidiana riducendo i compensi al minimo e un miglioramento della percezione e reclutamento del quadricipite [18].
Il recupero della Forza muscolare e delle sue determinanti verranno raggiunte in parte nella fase intermedia in quanto in presenza di inibizione artrogenica muscolare (AMI) le unità motorie (UM) ad alto soglia sono in gran parte inibite e silenziate dal sistema nervoso centrale.
Questo meccanismo è derivato da una disfunzione del sistema gamma-loop con conseguente ridotta sensibilità del gamma-motoneurone e inibizione di unità motorie ad alta soglia.
Date le connessioni e i meccanismi di cross-over neuronale a livello spinale, queste alterazioni si verificano anche a livello contro-laterale portando ad una debolezza parziale del quadricipite nel lato sano.
Viceversa, le unità motorie a bassa soglia, quelle che vengono reclutate in compiti a bassa richiesta (mantenimento posizione eretta, cammino ecc…) e che permettono piccoli adattamenti di posizione sono potenzialmente reclutabili.
Il sistema nervoso centrale, in pratica, crea uno schema di attivazione protettivo facilitando un pool di unità motorie e inibendo delle altre per preservare la funzionalità dell’arto inferiore.
I principali adattamenti motori maladattativi che vengono solitamente a crearsi sono (3):
- inibizione quadricipite;
- iper-reclutamento hamstring;
- aumento tono muscoli postero-laterali d’anca;
- aumento tono soleo e gastrocnemio.
In virtù di quanto detto è poco interessante lavorare su parametri di forza nella prima fase post chirurgica ma è molto più indicato normalizzare quelle alterazioni che dis-regolano l’output neuro-motorio.
Recenti evidenze scientifiche hanno messo in luce alcune strategie terapeutiche che minimizzerebbero questa tendenza inibitoria post lesionale:
- la contrazione eccentrica riduce i meccanismi inibitori e mantiene alta l’eccitabilità del fuso (Konishi 2009);
- la vibrazione a livello degli hamstrings induce fatigue indotta e sfrutta i meccanismi di inibizione reciproca facilitando il reclutamento del quadricipite (Konishi 2010);
- TENS (Konishi 2010).
Oltre a queste appena descritte, alcune strategie neuro-cognitive, come l’utilizzo di un focus attentivo esterno che faciliterebbe l’eccitabilità cortico-spinale, potrebbero essere utili già in prima fase.
Clausen e colleghi (2020) hanno dimostrato un netto e superiore miglioramento della forza in tutti quei soggetti che associavano un training neuro-motorio con un gaming approach che fungeva da bio-feedback enfatizzando divertimento e quindi adesione al trattamento (19).
I criteri necessari per poter passare alla fase intermedia sono (15):
- dolore, non superiore a 2/10 scala NRS;
- gonfiore, nessuna di gonfiore allo stroke test;
- estensione completa, prone hang test 0°;
- flessione, almeno 120°;
- reclutamento quadricipite, no lag sign per almeno 10 secondi;
- pattern cammino normalizzato.
Il dolore e il gonfiore sono 2 parametri necessari da normalizzare il più velocemente possibile in quanto considerati barriere al recupero neuro-motorio.
L’estensione completa inoltre permette una maggior qualitativo reclutamento del quadricipite.
Infine il reclutamento è predittivo di più o meno qualità futura: la presenza di un lag sign 10s a 5 settimane post surgery è da considerarsi predittivo per una debolezza futura a 6 mesi.
Le principali considerazioni per la fase intermedia possono essere raggruppate in 3 categorie (15):
- forza muscolare;
- qualità di movimento;
- fitness cardio-respiratorio.
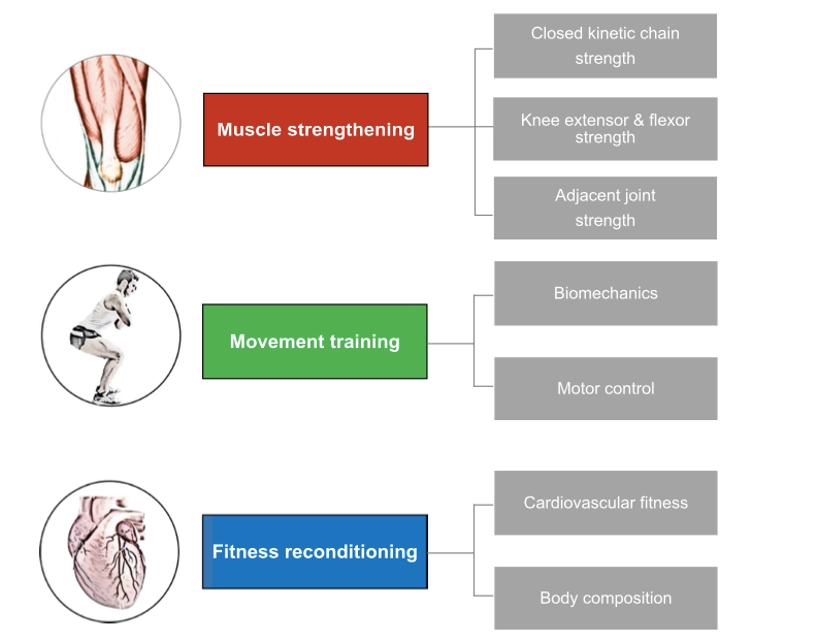
La priorità chiave della riabilitazione in fase intermedia è il ripristino almeno sub-totale della forza del complesso estensorio del ginocchio.
Tale parametro dovrebbe essere non superiore al 20% di differenza entro la fine della fase intermedia, elemento necessario per strutturare l’ultimo stage del processo riabilitativo.
Deficit superiori al 20% sono relazionati a scarsa funzionalità dell’intero arto inferiore e rischio di re-injury futuro.
La principale difficoltà nel ripristino della forza è l’inibizione muscolare artrogenica (AMI), che ostacolerebbe l’ipertrofia e la forza muscolare. Ecco perché la fase 1 è necessaria e fondamentale per facilitare e massimizzare la fase intermedia.
La domanda che molto frequentemente ci facciamo è? Da dove parto? Quale esercizio somministro per primo e con quale carico?
È importante pianificare un programma che esponga il soggetto a tutti i tipi di carico e soprattutto che crei una tolleranza incrementale.
Il carico viene dissipato a livello del sistema neuro-muscolare e assorbito passivamente da strutture tendinee, legamentose e ossee. Un deficit di forza significherebbe una minor capacità di assorbimento eccentrica degli stress meccanici durante compiti motori ad alta richiesta ed una maggior dipendenza da complessi articolari per l’assorbimento passivo.
È quindi necessariamente importante comprendere come il carico viene distribuito a livello del sistema neuro-muscolo-scheletrico analizzando e interpretando la cinematica del movimento.
La pianificazione nel breve periodo deve essere ragionata quindi in termini di (20):
- picco di carico tensile e forze di taglio sul legamento in relazione al tempo biologico;
- volume di lavoro complessivo;
- soggettività.
Dunque, un elemento chiave per la progressione degli esercizi è conoscere l’impatto che questi hanno sul neo-legamento.
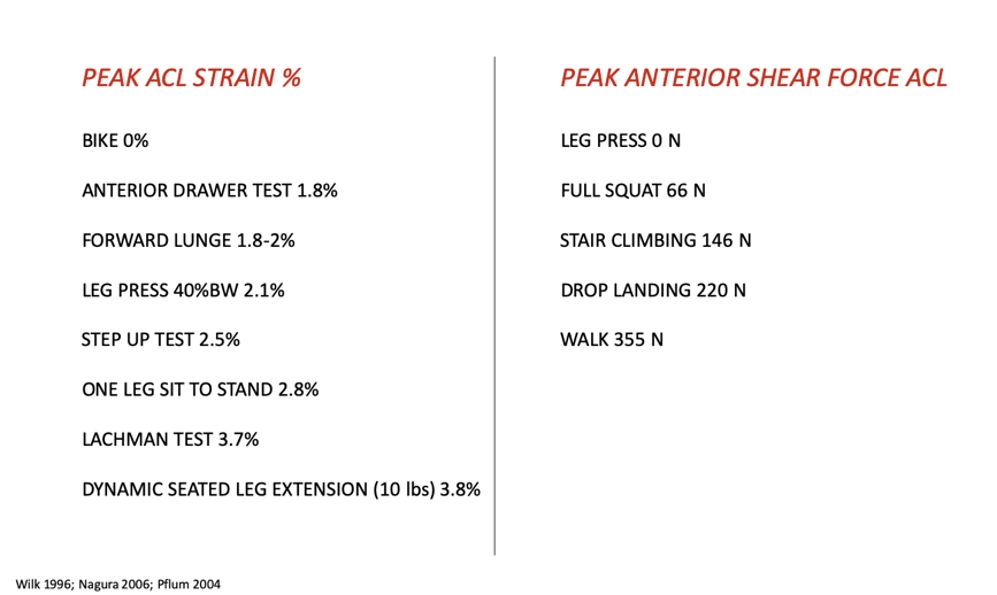
Gli studi di Escamilla e colleghi del 2012 (21) hanno dato una visione completa riguardante questo topic (fig.6) :
- gli esercizi in catena cinetica chiusa riducono gli stress sul neo-legamento;
- gli esercizi con maggior flessione di tronco aumentano il reclutamento degli hamstring e quindi la protezione sul neo-legamento;
- gli esercizi non-weight bearing (NWB) e weight-bearing (WB) con un angolo di flessione > 60° producono minimo stress sul legamento;
- il picco di strain sul legamento viene raggiunto tra i 10 e 15 gradi di flessione in catena cinetica aperta;
- una leg extension isometrica a 60° produce 0% di strain mentre a 15° produce 4%.
Ancora, rapide accelerazioni e decelerazioni, cambi di direzione e atterraggi da box ad una gamba presentano alti livelli di stress sul neo-legamento vicini ai 1800N.
La resistenza tensile del legamento nativa è età dipendente con una variabilità che si aggira tra i 2300N nei soggetti sotto i 25 anni e 1600N nei soggetti sopra i 40 anni.
Per ulteriori informazioni vi consiglio di consultare il paper presente in bibliografia (21).
Oltre alla sfera meramente meccanica, è importante analizzare la percezione del soggetto.
Tutti gli esercizi che somministriamo dovrebbero essere pain free, almeno tollerabili per il soggetto, soprattutto quelli ad alto carico.
La progressione tra un esercizio e l’altro o tra un carico e l’altro dovrebbe avvenire solamente quando il soggetto è in grado di gestire il compito senza dolore e senza reazioni edemigene indotte nelle successive ore post training. Questo perché, come ribadito in precedenza, gonfiore e dolore sono 2 limitatori che ridurrebbero l’output motorio (20).
L’obiettivo riabilitativo è dunque creare una progressione di movimento e di carico tollerabile per il soggetto.
Come descritto da Della Villa e colleghi nel 2020 (20), è interessante creare una programma che comprenda esercizi chiave all’interno del processo riabilitativo (fig.7):
- bilateral squat;
- goblet squat;
- split squat;
- lunge;
- step down;
- single leg squat.
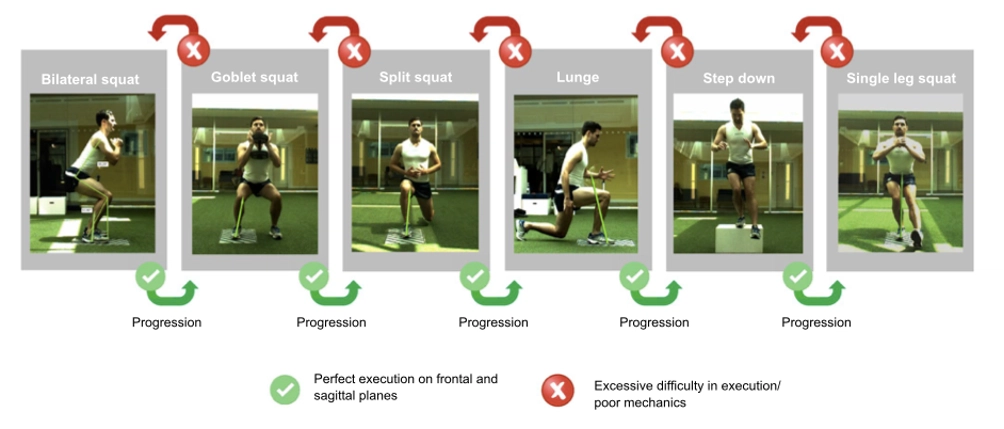
Ognuno di questi esercizi può essere arricchito da variabili e determinanti dell’esercizio sulla base del ragionamento clinico e della risposta adattativa o meno del soggetto:
- carico naturale o carico esterno;
- open skills vs closed skills;
- cognitive overload;
- fatica o non fatica.
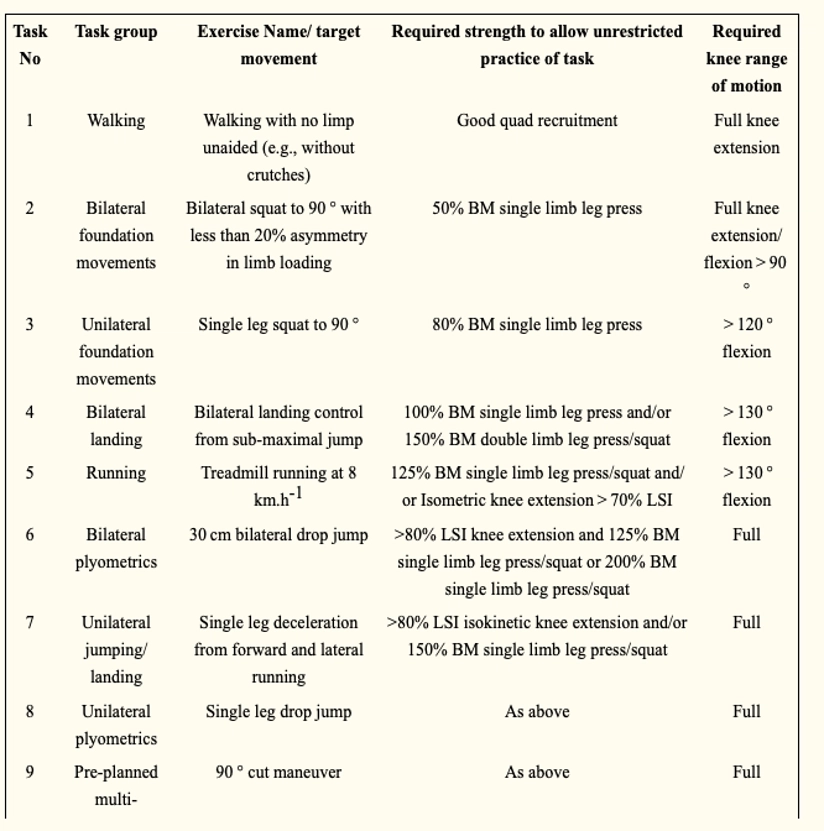
Ancora, Della Villa e colleghi, in uno studio del 2020 (20), hanno delineato un task based progression con l’obiettivo di programmare dei “must exercise” con relativi criteri da raggiungere come citato in tabella passando per una normalizzazione del cammino, una gestione di carico bilaterale, una di carico singolo, capacità di assorbimento via landing exercise, return to running, esercizi pliometrici e infine esercizi sport-specifici programmati e non programmati con più o meno variabili cognitive.
Ognuno di questi presentava criteri di progressione.
Uno dei topic forse più discussi della riabilitazione LCA è il return to running.
Il principale criterio ad oggi utilizzato è il tempo: 3 mesi dalla chirurgia.
Sappiamo essere un criterio discutibile e poco concordato in letteratura.
La corsa è un’attività complessa, che determina una quantità elevata di ground reaction force (fino a 3-4 volte il peso corporeo) che dev’essere assorbita dal sistema muscolo-scheletrico.
La ground reaction force (GRF) può essere osservata in 2 fasi durante la corsa: nella fase di impatto e nella fase mid-stance (22).
La fase di impatto è considerata la più importante e quella con maggior tasso di injuries.
Durante tale fase le strutture attive e passive devono mettere in atto capacità di assorbimento di carico (22).
Questa capacità è dettata soprattutto dall’azione eccentrica dal complesso muscolo-tendineo che dev’essere in grado di dissipare l’energia lungo l’intero arto inferiore non creando aree di sovraccarico.
Nella tabella è possibile notare l’intensità della ground reaction force (GRF) in 4 differenti attività di progressione della corsa: jogging, running, acceleration, high speed running (fig.9).
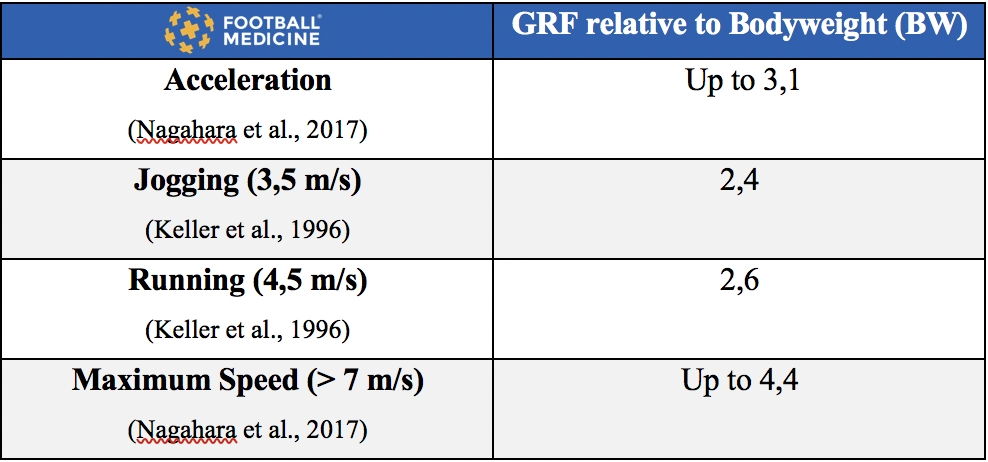
Il nostro sistema deve quindi essere in grado di assorbire forze considerevoli, ecco perché lo strength training è considerato propedeutico per il return to running (RTR) ed ecco perché è necessario un Limb Symmetry Index (LSI) strength maggiore dell’80% come parametro per il return to running (RTR).
Mentre un soggetto sta correndo le forze di impatto potrebbero essere elevate quanto l’esecuzione di un hang power clean al 90% 1RM con la notevole particolarità che durante la corsa questo carico verrebbe assorbito dal singolo arto inferiore (22).
La forza però non è l’unico parametro, è solo la punta dell’iceberg.
Osservando la tabella qui sotto è possibile notare come la corsa è un attività che presenta dei tempo di contatto al suolo di durata molto breve a dipendenza della velocità. Questo in termini pratici significa che, oltre alla forza, un’interessante parametro da prendere in considerazione è la rate force of development (RFD) considerata come la capacità di gestire un carico o il proprio preso corporeo nel minor tempo possibile. Due atleti potrebbero raggiungere la stessa altezza durante un salto ma l’atleta A potrebbe raggiungerla in un intervallo di tempo minore.
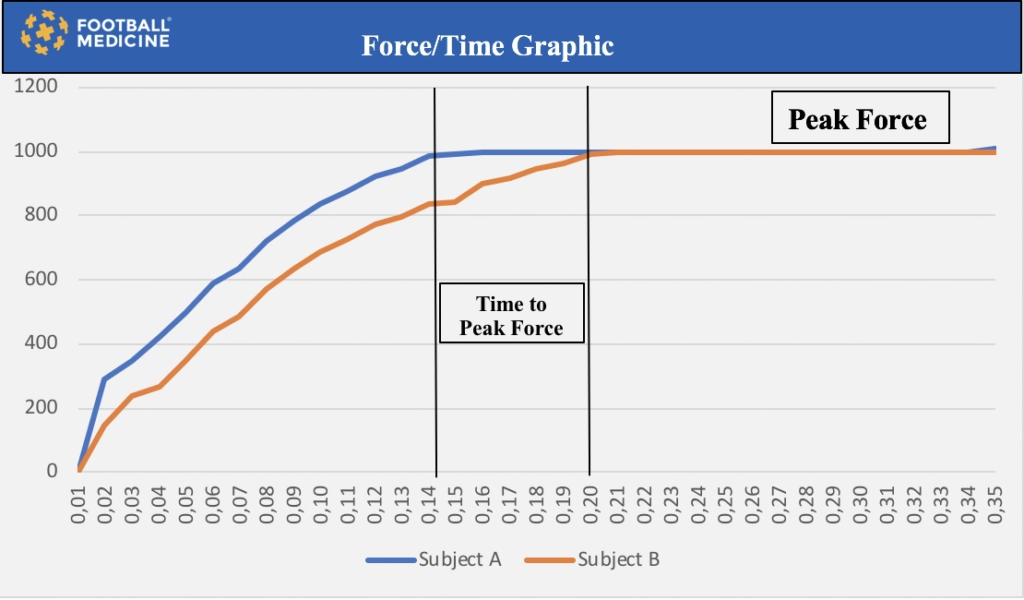
Ecco come oltre lo strength training anche il power training è decisamente importante.
I programmi di return to running sono necessariamente graduali e incrementali e paralleli al lavoro di carico tessutale. Non possiamo pretendere di esporre un soggetto alla corsa se non abbiamo creato adeguati requisiti di capacità di assorbimento di forze richiesto dal compito.
L’ultima fase riabilitativa è quella definita avanzata laddove gli obiettivi sono quelli di tradurre in termini sport-specifici le abilità e capacità create in un ambiente closed skill (23)
Qui il lavoro di strength training, power training, agility, speed training dovrà essere mantenuto in parallelismo a compiti sport specifici ricreando situazioni di gioco il più realistiche possibile sotto ogni punto di vista: situazionale, motivazionale, di fatica, distrattivo (23).
L’obiettivo dell’ultima fase è rendere il soggetto responder a stimoli variabili e distrattivi in contesti di gioco caotici e complessi in modo da mettere in grande difficoltà e in situazione di problem solving il sistema nervoso centrale (23)
In ultimo non dimentichiamo di analizzare la sfera emotiva-affettiva e comportamentale del soggetto ricordando che elementi come la paura potrebbero giocare un ruolo cardine nel re-injury.
Conclusioni
Concludendo, la riabilitazione LCA è estremamente complessa e multi-disciplinare e comporta soprattutto innumerevoli abilità da parte del clinico: capacità di monitoraggio e programmazione a lungo termine basata su criteri di progressione, rispetto di tempi biologici e conoscenza di questi, conoscenza di fondamentali cinematici e cinetici, capacità di monitoring del dosaggio terapeutico dell’esercizio, conoscenza della biomeccanica dell’esercizio e infine capacità comunicative, relazionali e motivazionali da parte del clinico.
-
- Return to sport following anterior cruciate ligament reconstruction surgery: a systematic review and meta-analysis of the state of play. Arden 2011
- Anatomy of the anterior cruciate ligament. Duthon 2006.
- Nyland J, Gamble C, Franklin T, Caborn DNM. Permanent knee sensorimotor system changes following ACL injury and surgery. Knee Surg Sports Traumatol Arthrosc. 2017 May;25(5):1461-1474. doi: 10.1007/s00167-017-4432-y. Epub 2017 Feb 2. PMID: 28154888.
- Barrack RL, Lund PJ, Munn BG, Wink C, Happel L. Evidence of reinnervation of free patellar tendon autograft used for anterior cruciate ligament reconstruction. Am J Sports Med. 1997 Mar-Apr;25(2):196-202. doi: 10.1177/036354659702500210. PMID: 9079173.
- Moksnes H, Snyder-Mackler L, Risberg MA. Individuals with an anterior cruciate ligament-deficient knee classified as noncopers may be candidates for nonsurgical rehabilitation. J Orthop Sports Phys Ther. 2008 Oct;38(10):586-95. doi: 10.2519/jospt.2008.2750. PMID: 18979658; PMCID: PMC2801138.
- Cochrane review 2011, Macualay sports health 2011, JAAOS 2011 ACL autograft outcomes.
- Ekdahl M, Wang JH, Ronga M, Fu FH. Graft healing in anterior cruciate ligament reconstruction. Knee Surg Sports Traumatol Arthrosc. 2008 Oct;16(10):935-47. doi: 10.1007/s00167-008-0584-0. Epub 2008 Jul 17. PMID: 18633596.
- Kan SL, Yuan ZF, Ning GZ, Yang B, Li HL, Sun JC, Feng SQ. Autograft versus allograft in anterior cruciate ligament reconstruction: A meta-analysis with trial sequential analysis. Medicine (Baltimore). 2016 Sep;95(38):e4936. doi: 10.1097/MD.0000000000004936. PMID: 27661048; PMCID: PMC5044918.
- Chen CH, Chuang TY, Wang KC, Chen WJ, Shih CH. Arthroscopic anterior cruciate ligament reconstruction with quadriceps tendon autograft: clinical outcome in 4-7 years. Knee Surg Sports Traumatol Arthrosc. 2006 Nov;14(11):1077-85. doi: 10.1007/s00167-006-0111-0. Epub 2006 Jun 24. PMID: 16799828..
- Shani RH, Umpierez E, Nasert M, Hiza EA, Xerogeanes J. Biomechanical Comparison of Quadriceps and Patellar Tendon Grafts in Anterior Cruciate Ligament Reconstruction. Arthroscopy. 2016 Jan;32(1):71-5. doi: 10.1016/j.arthro.2015.06.051. Epub 2015 Sep 14. PMID: 26382635..
- Kondo E, Yasuda K, Katsura T, Hayashi R, Kotani Y, Tohyama H. Biomechanical and histological evaluations of the doubled semitendinosus tendon autograft after anterior cruciate ligament reconstruction in sheep. Am J Sports Med. 2012 Feb;40(2):315-24. doi: 10.1177/0363546511426417. Epub 2011 Nov 16. PMID: 22088579..
- Zaffagnini S, De Pasquale V, Marchesini Reggiani L, Russo A, Agati P, Bacchelli B, Marcacci M. Electron microscopy of the remodelling process in hamstring tendon used as ACL graft. Knee Surg Sports Traumatol Arthrosc. 2010 Aug;18(8):1052-8. doi: 10.1007/s00167-009-0925-7. Epub 2009 Sep 29. PMID: 19787336.
- Grindem H, Snyder-Mackler L, Moksnes H, et al. Simple decision rules can reduce reinjury risk by 84% after ACL reconstruction: the Delaware-Oslo ACL cohort study. British Journal of Sports Medicine 2016;50:804-808..
- Burgi CR, Peters S, Ardern CL, Magill JR, Gomez CD, Sylvain J, Reiman MP. Which criteria are used to clear patients to return to sport after primary ACL reconstruction? A scoping review. Br J Sports Med. 2019 Sep;53(18):1154-1161. doi: 10.1136/bjsports-2018-099982. Epub 2019 Feb 2. PMID: 30712009.
- Buckthorpe M, Della Villa F. Optimising the ‘Mid-Stage’ Training and Testing Process After ACL Reconstruction. Sports Med. 2020 Apr;50(4):657-678. doi: 10.1007/s40279-019-01222-6. PMID: 31782065.
- de Valk EJ, Moen MH, Winters M, Bakker EW, Tamminga R, van der Hoeven H. Preoperative patient and injury factors of successful rehabilitation after anterior cruciate ligament reconstruction with single-bundle techniques. Arthroscopy. 2013 Nov;29(11):1879-95. doi: 10.1016/j.arthro.2013.07.273. PMID: 24209682.
- Shaarani SR, O’Hare C, Quinn A, Moyna N, Moran R, O’Byrne JM. Effect of prehabilitation on the outcome of anterior cruciate ligament reconstruction. Am J Sports Med. 2013 Sep;41(9):2117-27. doi: 10.1177/0363546513493594. Epub 2013 Jul 11. PMID: 23845398.
- Herrington L, Myer G, Horsley I. Task based rehabilitation protocol for elite athletes following anterior cruciate ligament reconstruction: a clinical commentary. Phys Ther Sport. 2013;14(4):188–98.
- Clausen JD, Nahen N, Horstmann H, Lasch F, Krutsch W, Krettek C, Weber-Spickschen TS. Improving Maximal Strength in the Initial Postoperative Phase After Anterior Cruciate Ligament Reconstruction Surgery: Randomized Controlled Trial of an App-Based Serious Gaming Approach. JMIR Serious Games. 2020 Jan 24;8(1):e14282. doi: 10.2196/14282. PMID: 32012046; PMCID: PMC7007586.
- Buckthorpe, M., Tamisari, A., & Villa, F. D. (2020). A TEN TASK-BASED PROGRESSION IN REHABILITATION AFTER ACL RECONSTRUCTION: FROM POST-SURGERY TO RETURN TO PLAY – A CLINICAL COMMENTARY. International journal of sports physical therapy, 15(4), 611–623.
- Escamilla RF, Macleod TD, Wilk KE, Paulos L, Andrews JR. Anterior cruciate ligament strain and tensile forces for weight-bearing and non-weight-bearing exercises: a guide to exercise selection. J Orthop Sports Phys Ther. 2012 Mar;42(3):208-20. doi: 10.2519/jospt.2012.3768. Epub 2012 Feb 29. PMID: 22387600.
- Dugan SA, Bhat KP. Biomechanics and analysis of running gait. Phys Med Rehabil Clin N Am. 2005 Aug;16(3):603-21. doi: 10.1016/j.pmr.2005.02.007. PMID: 16005396.
- Buckthorpe M. Optimising the Late-Stage Rehabilitation and Return-to-Sport Training and Testing Process After ACL Reconstruction. Sports Med. 2019 Jul;49(7):1043-1058. doi: 10.1007/s40279-019-01102-z. PMID: 31004279.
